一、共价键三种类型
1、按成键方式:σ键(sigmabond);π键(pibond);δ键(deltabond)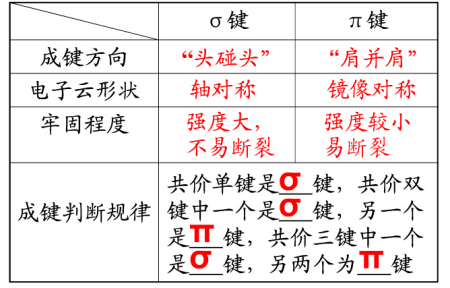
2、按成键过程:一般共价键;配位共价键(coordinatecovalentbond)。
3、按电子偏向:极性共价键(polarbond);非极性共价键(non-polarbond)。
共价键是化学键中重要的一类,包括:极性键、非极性键、配位键、单键、双键、叁键、σ键、π键等类别。
二、共价键的类型有哪些?
极性共价键,非极性共价键。
共价键的分类方法很多,可以从不同的角度分类:
1、从共用电子对是否偏移,分成 偏移的------------极性键 不偏移--------------非极性键
2、从形成的共用电子对的数目,分成 1对----------单键 2对-------------双键 3对-------------叁键
3、从共用电子对的形成方式,分成 电子对来自成键原子双方,即两个原子都拿出相等的电子,形成共用电子对-----------共价键 电子对来自一方,即一方提供孤对电子,一方提供空轨道--------------配位键
4、电子对形成时的重叠方式 头碰头重叠-----------西格玛键 肩并肩重叠------------派键 若肩并肩重叠的原子数达到3以上-------------大派键
三、无机化学:共价键的类型有哪些
共价键的类型
一,σ键和π键
相互靠拢
s-s
s-p
p-p
原子轨道以"肩并肩"方式相互重叠导致电子在核间出现的概率增大而形成的共价键
2,π键
σ键的常见类型有(1)s-s,(2)s-p,(3)p-p,请指出下列分子σ键所属类型:
A,HBr
B,NH3
C,F2
D,H2
课堂练习
s-p
s-p
p-p
s-s
2,已知π键可吸收紫外线,含π键物质可做护肤品.请问下列物质中哪些是含有π键的分子( )
A. H2O B. CH4
C. CO2 D. C2H2
课堂练习
CD
3,σ键和π键的比较
成键判断规律
牢固程度
电子云形状
成键方向
π键
σ键
"头碰头"
"肩并肩"
轴对称
镜像对称
强度大,不易断裂
强度较小易断裂
共价单键是 键,共价双键中一个是 键,另一个是 键,共价三键中一个是 键,另两个为 键
σ
σ
π
σ
π
乙烷,乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成
问题探究二
乙烷: 个σ键
乙烯: 个σ键 个π键
乙炔: 个σ键 个π键
7
5
1
3
2
乙烯,乙炔分子中轨道重叠方式示意图
问题探究三
请写出乙烯,乙炔与溴发生加成反应的反应方程式.并思考:在乙烯,乙炔和溴发生的加成反应中,乙烯,乙炔分子断裂什么类型的共价键
π键的重叠程度小于σ键,所以π键不如σ键稳定.
问题探究四
根据氢原子和氟原子的核外电子排布,你知道F2和HF分子中形成的共价键有什么不同吗
根据元素电负性的强弱,你能判断F2和HF分子中共用电子对是否发生偏移吗
二,极性键和非极性键
1,非极性键:
两个成键原子吸引电子的能力 (电负性 ),共用电子对 偏移的共价键
相同
不发生
相同
2,极性键:
两个成键原子吸引电子的能力 (电负性 ),共用电子对 偏移的共价键
不同
发生
不同
3,一般情况下,同种元素的原子之间形成 共价键,不同种元素的原子之间形成 共价键.
非极性
极性
4,在极性共价键中,成键原子吸引电子能力的差别越大,即电负性差值越大,共用电子对的偏移程度 ,共价键的极性 .
越大
越大
极性分子与非极性分子
电荷分布均匀对称的分子称非极性分子,如氯分子.
电荷分布不均匀对称的分子称极性分子,如氯化氢.
非极性键 非极性分子,如H2,O2,Cl2, N2 .
构成
极 性 键
构成
非极性分子,如CO2,CH4, CCl4 .
极性分子,如HCl,H2O,NH3
(分子空间结构对称)
问题探究五
在水溶液中,NH3能与H+结合生成NH4+
请用电子式表示N和H形成NH3的过程并讨论NH3和H+是如何形成NH4+的
写出氨与盐酸反应的化学方程式和离子方程式.
:
H N
:
:
:
H
H
H-N →H
H
H
氮原子有孤对电子,氢离子有空轨道.
NH3 + HCl = NH4Cl
NH3 + H+ = NH4+
氨分子中各原子均达稳定结构,为什么还
能与氢离子结合
H+
+
→
:
H N H
:
:
:
H
H
+
+
或
共用电子对全部由氮原子提供.
配 位 键
铵根离子与水合氢离子等是通过配位键形成的.
:
H O
:
:
:
H
+
H+
→
:
H O H
:
:
:
H
+
由一个原子提供一对电子与另一个接受电子对的原子形成共价键,这样的共价键称为配位键.
:
H N
:
:
:
H
H
H-N →H
H
H
在铵根离子中,四个N-H 键的键长,键能,键角均相等,表现的化学性质也完全相同.所以铵根离子通常用下式表示:
H+
+
→
:
H N H
:
:
:
H
H
+
或
H-N-H
H
H
+
+
1,关于乙醇分子的说法正确的是( )
A,分子中共含有8个极性键
B,分子中不含非极性键
C,分子中只含σ键
D,分子中含有1个π键
C
课堂练习
课堂练习
7
3
课堂练习
3,下列分子中含有非极性键的共价化合物是( )
A,F2 B,C2H2 C,Na2O2 D,NH3
B
练习
在下列物质中: ⑴ Cl2 ⑵ NaI ⑶ H2S ⑷ CO2 ⑸ CaCl2 ⑹ N2 ⑺ CCl4 ⑻ Na2O ⑼ NH3 ⑽ HBr
⒈含离子键的物质是:
⒉含有共价键的化合物是:
⒊由极性键形成的非极性分子是:
⒋由非极性键形成的非极性分子是:
NaI
CaCl2
Na2O
H2S
CO2
CCl4
NH3
HBr
CO2
CCl4
Cl2
N2